La Federación Europea de la Industria Farmacéutica (Efpia) ha publicado el informe ‘Indicadores de acceso a terapias innovadoras en Europa 2023 (W.A.I.T. Indicator)’, elaborado por Iqvia. Según este documento, al arranque de 2024 España tenía pendiente de incorporar en la financiación pública el 38% de los medicamentos innovadores aprobados por la EMA entre 2019 y 2022. En total, 64 fármacos de los 167 registrados entre los que se encuentran, principalmente, tratamientos oncológicos y medicamentos huérfanos para enfermedades raras.
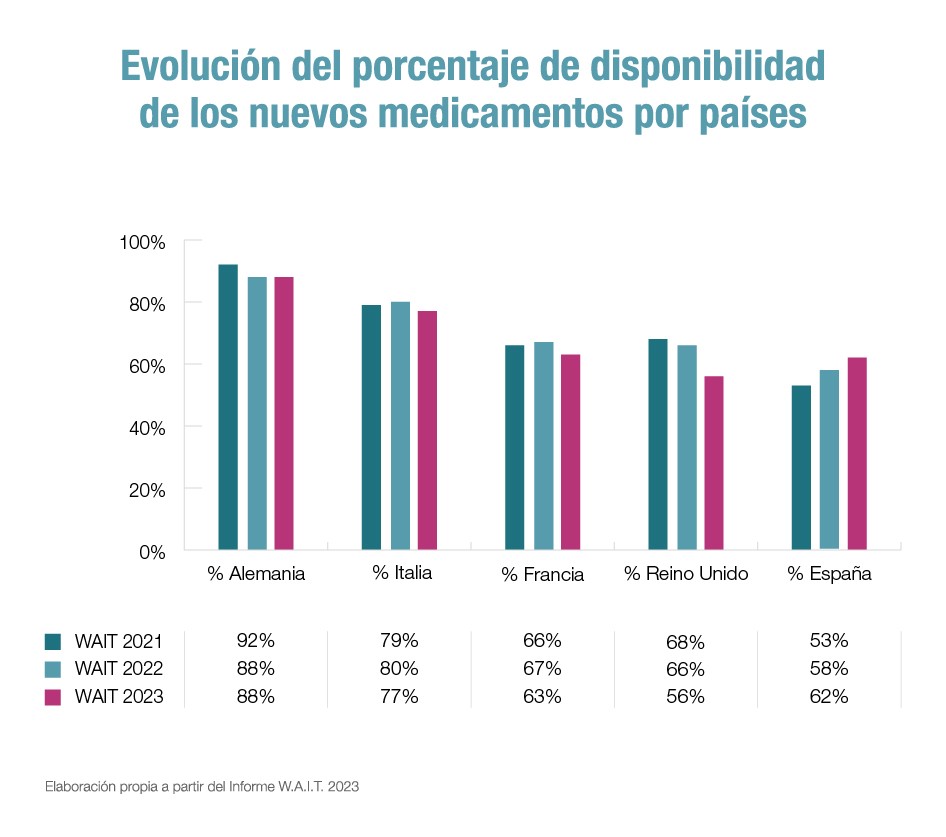
No obstante, las cifras muestran una mejora con respecto a periodos anteriores en nuestro país: en el estudio de 2023 se refleja un porcentaje de terapias aprobadas del 62%, frente al 58% de 2022 y al 53% de 2021. Es decir, se ha aumentado un 9% en dos años, a diferencia de otros países de nuestro entorno, como Francia, Italia, Alemania y Reino Unido, en los que esas cifras han empeorado. Eso sí, la mayoría mantienen porcentajes superiores a los de España.
- Te interesa: Las organizaciones de pacientes plantean sus reivindicaciones de cara a las elecciones europeas
Por otra parte, el informe calcula también los tiempos medios de demora desde la aprobación del medicamento por la EMA y su aplicación en los pacientes, que en el caso de España alcanza los 22 meses. De hecho, en este punto las cifras empeoran, pasándose de los 517 de espera de 2021 a los 661 de 2023, casi 5 meses más de espera para tener acceso a un medicamento innovador.
Esta cifra también supera con creces los 531 días de media de espera registrada en el continente europeo, donde la disponibilidad de medicamentos es de un 43%, una cifra ligeramente menor a la del informe de 2022. De hecho, a nivel del continente existen grandes diferencias, la máxima entre Alemania, con un 88%, y Malta, con un 4%.
Restricciones
Además, el documento asegura que un 52% de los fármacos que obtienen financiación están sujetos a restricciones en cuanto a las indicaciones para las que pueden ser prescritos. Un porcentaje que también ha empeorado desde 2021, con un 41%. Es decir, un 10% más de nuevos fármacos que sólo pueden prescribirse si se cumplen determinados requisitos.
Para aquellos pacientes que no tienen tiempo que perder, el Ministerio de Sanidad aporta una opción para agilizar el acceso: la solicitud individualizada, regulada por Real Decreto para disponer de determinados medicamentos en situaciones especiales. Un sistema diferente al de acceso precoz que rige en otros países de la unión, por la que grupos de pacientes definidos tienen la posibilidad de acortar el tiempo de disponibilidad y mejorar el acceso.
Alternativas
En este sentido, la patronal farmacéutica española, Farmaindustria, ha presentado una ‘Propuesta para el acceso temprano a los medicamentos innovadores’. Una fórmula que permitiría aprobar financiaciones aceleradas en un plazo máximo de 90 días sin necesidad de implantar cambios normativos. De esta manera, se aportarían mayores oportunidades a aquellos pacientes con enfermedades graves o que no tienen alternativa terapéutica.
“Es importante garantizar que todos los pacientes reciban el mejor tratamiento posible en condiciones de equidad, y en ocasiones eso no es posible con la dinámica actual. Por eso, proponemos que se establezcan criterios y un sistema claro y predecible que mejore la disponibilidad de los nuevos tratamientos cuando más se necesitan”, indica Juan Yermo, director general de Farmaindustria.
Acciones como éstas son muy demandadas desde las asociaciones de pacientes, que llevan años reclamando mejoras urgentes en este sentido. En general solicitan acortar los tiempos de aprobación y disponibilidad de medicamentos, reducir las restricciones y garantizar una mayor equidad en el acceso a terapias innovadoras. Además subrayan la importancia de que los pacientes tengan un papel activo y significativo en los procesos de evaluación y toma de decisiones, para asegurar que sus necesidades sean escuchadas y atendidas adecuadamente.
- Si quieres consultar el informe completo, puedes hacerlo aquí.



