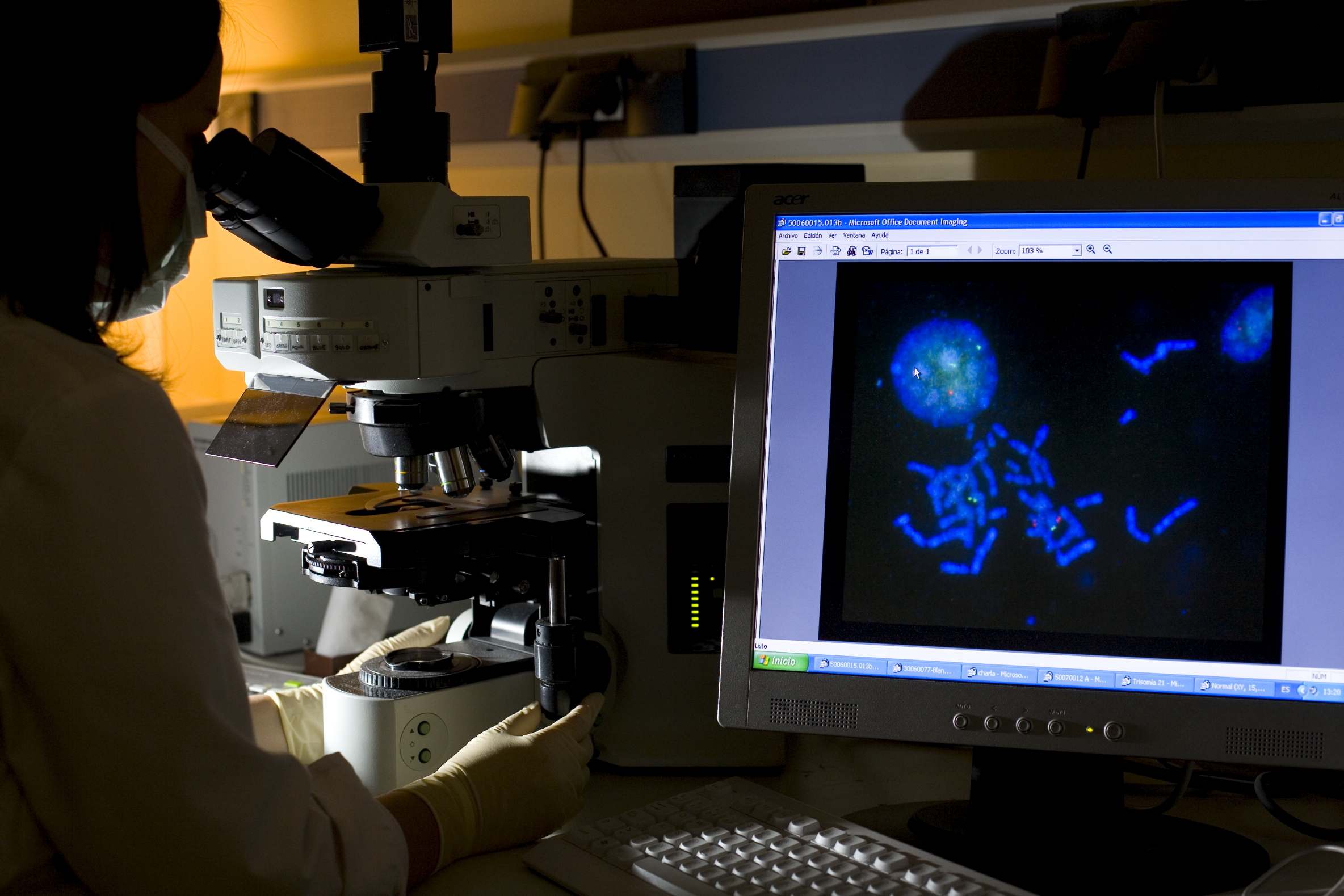
 En 2017, el 40% de todos los medicamentos aprobados en Europa y Estados Unidos que incluyen un nuevo principio activo estaban indicados para el tratamiento de dolencias poco frecuentes. Los datos de las dos principales agencias reguladoras del mundo, la European Medicines Agency (EMA) y la Food and Drug Administration (FDA) de Estados Unidos, confirman esta tendencia.
En 2017, el 40% de todos los medicamentos aprobados en Europa y Estados Unidos que incluyen un nuevo principio activo estaban indicados para el tratamiento de dolencias poco frecuentes. Los datos de las dos principales agencias reguladoras del mundo, la European Medicines Agency (EMA) y la Food and Drug Administration (FDA) de Estados Unidos, confirman esta tendencia.
En el primer caso, el 40% de los 35 medicamentos con un nuevo principio activo que recibieron opinión positiva de la EMA, es decir 14, son para tratar enfermedades poco frecuentes. La propia EMA señala que el actual marco vigente sobre enfermedades raras favorece la I+D en estas dolencias por parte de la industria farmacéutica, y destaca las aportaciones terapéuticas de los nuevos fármacos huérfanos, entre los que figuran medicamentos contra patologías consideradas raras como la queratitis neurotrófica, el neuroblastoma o el síndrome carcinoide, entre otras.
En lo que se refiere a Estados Unidos, los datos coinciden en líneas generales con los europeos, ya que un total de 18 medicamentos, que representan el 39% de las nuevas moléculas aprobadas por la FDA durante el año pasado, son terapias dirigidas a enfermedades poco frecuentes (que afectan a menos de 200.000 ciudadanos en el conjunto de Estados Unidos). Entre estos nuevos medicamentos, la FDA destaca un nuevo fármaco para tratar una forma específica de la enfermedad de Batten y otro dirigido a prevenir o reducir los episodios hemorrágicos en pacientes con un tipo concreto de hemofilia A.