Los medicamentos innovadores suponen en muchas ocasiones la única alternativa con la que cuentan los pacientes para hacer frente a su enfermedad. Pero hay un problema: son muchos los casos en los que el tiempo que transcurre entre su aprobación europea y su financiación en España, es decir, hasta que llega de forma efectiva al paciente, es demasiado largo. Para agilizar este proceso, Farmaindustria, Asociación Nacional Empresarial de la Industria Farmacéutica, ha presentado su ‘Propuesta para el acceso temprano a los medicamentos innovadores’.
Juan Yermo, su director general, explica que “necesitamos garantizar que todos los pacientes reciben en condiciones de equidad el mejor tratamiento posible, y en ocasiones eso no es posible por las vías de financiación habituales. Proponemos que se establezcan criterios y un procedimiento claro y predecible que mejore la disponibilidad de los medicamentos innovadores cuando más se necesitan”.
En este contexto, si bien es cierto que ya existe un procedimiento que plantea soluciones individualizadas en situaciones excepcionales, en la práctica se generan situaciones de desigualdad entre comunidades autónomas o, incluso, entre hospitales de un mismo territorio.
La nueva propuesta, que no requiere ningún cambio legislativo, establece unos «criterios claros» para la determinación por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) de qué medicamentos serían objeto del procedimiento de acceso rápido. Concretamente, se trataría de aquellos orientados a una enfermedad rara, grave o incapacitante o en los que no exista alternativa de tratamiento o, de haberla, que el nuevo tratamiento aporte una mejoría significativa en eficacia o seguridad.
Así, una vez seleccionado el medicamento candidato, el plazo máximo tras la autorización en Europa para que la compañía farmacéutica solicite el código nacional, indispensable para su comercialización en España y, por ende, para el acceso temprano, sería de tan solo 15 días. El objetivo es alcanzar cuanto antes un acuerdo de financiación entre la Administración y la compañía, fijándose el plazo total en 90 días –la mitad del establecido en la normativa actual.
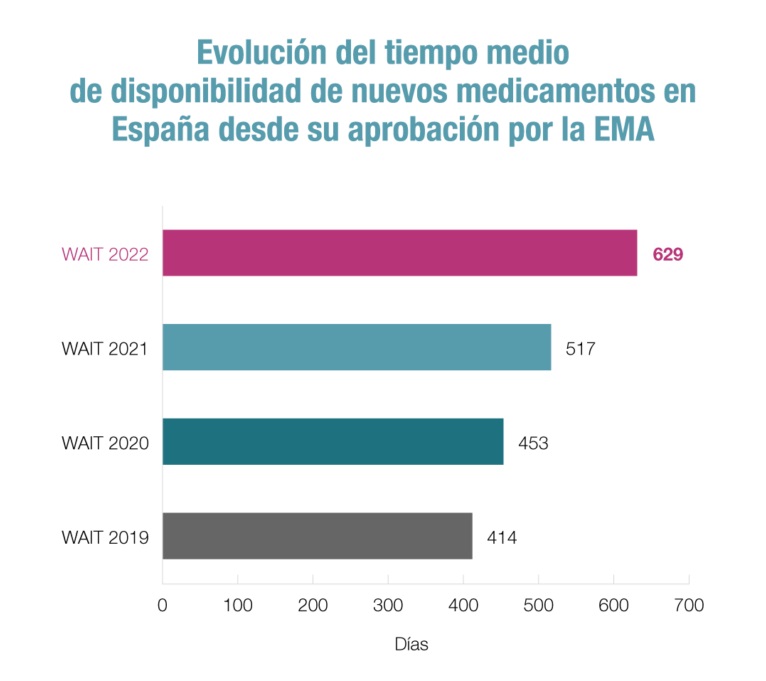
A día de hoy, el tiempo medio que transcurre desde que un nuevo medicamento se autoriza en Europa hasta que llega al sistema sanitario público español es de 629 días, muy superior al de países de nuestro entorno como Alemania (128), Italia (436) o Francia (508).
El nuevo documento de propuestas se enmarca en el compromiso de la industria farmacéutica innovadora para mejorar el acceso de los pacientes a los nuevos fármacos y sigue al documento de ‘Propuestas para la mejora del acceso de los pacientes a los medicamentos huérfanos’ y al informe ‘El acceso a los medicamentos en España: diagnóstico y recomendaciones’, ya presentados al Ministerio de Sanidad.