Los pacientes españoles tienen un problema a la hora de acceder a los nuevos medicamentos, que, como muestra los estudios, son responsables, al menos en una parte muy importante, de que vivan más años y con mayor calidad de vida. Y es que, si bien es cierto que la cifra de nuevos fármacos aprobados por la Agencia Europea del Medicamento que se encuentran a su disposición es mayor, también lo es el tiempo que transcurre entre su aprobación y su uso. Así lo muestran los datos del informe anual ‘Indicadores de acceso a terapias innovadoras en Europa 2022’ (W.A.I.T. Indicator) de la Federación Europea de Asociaciones de la Industria Farmacéutica (EFPIA).
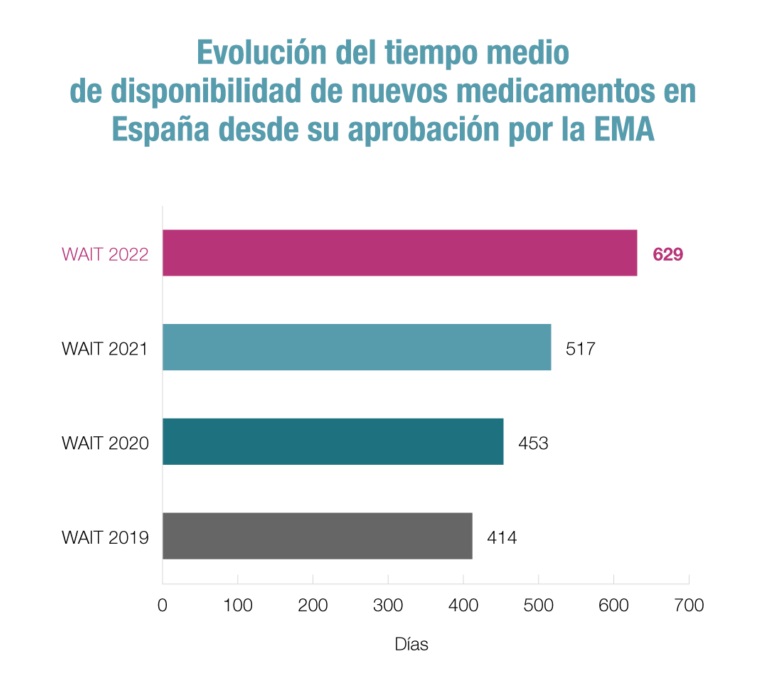
Concretamente, el informe, en el que analiza el estado de la financiación pública a 1 de enero de 2023 de los medicamentos autorizados entre 2018 y 2021, revela que el tiempo medio transcurrido entre la autorización de un medicamento por la UE y su incorporación al Sistema Nacional de Salud (SNS) se elevó en 2022 hasta los 629 días. Una demora que no ha dejado de crecer –517 días (2021), 453 días (2020), 414 días (2019)– y que cada vez se aleja más del plazo establecido por la legislación: 180 días.
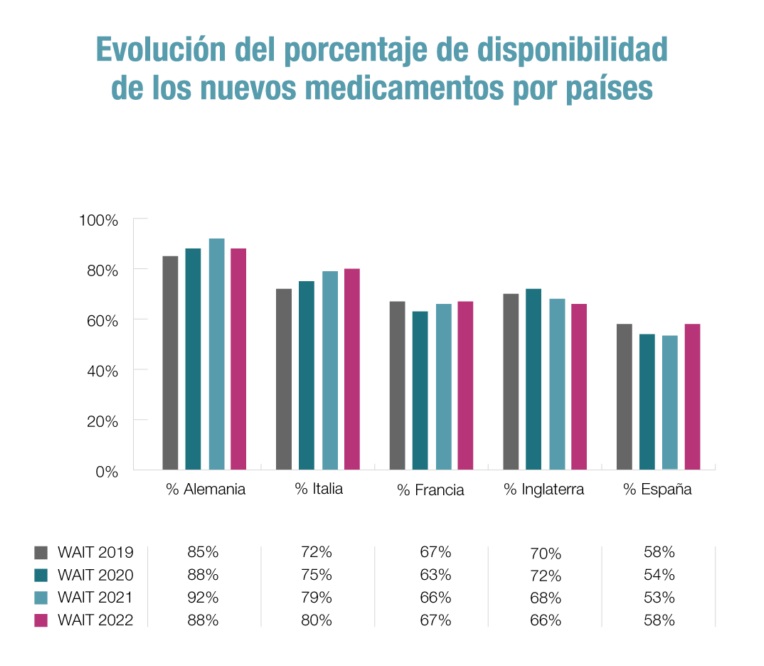
Ese tiempo es mayor en España que en el conjunto de la UE –517 días, seis más que el año anterior– y superior al de otros países de nuestro entorno como Alemania (128), Italia (436) o Francia (508). De hecho, y de un listado de 37 países, incluidos los 27 de la UE, España ocupa el puesto 28.
Disponibilidad limitada
El otro indicador que evalúa el estudio es la disponibilidad, es decir, el número de medicamentos que son incluidos en la financiación pública y puestos a disposición de los pacientes. Así, a 1 de enero de 2022 se encontraban disponibles en España 98 de los 168 medicamentos aprobados en la UE en el periodo 2018-2021. O lo que es lo mismo, el 58%. Y, si bien esta cifra ha mejorado –53% en 2021–, sigue siendo muy inferior a la de países como Alemania (88%) Italia (80%) o Francia (67%).
Los datos también muestran que el 51% de los nuevos medicamentos disponibles en nuestro país cuentan con una disponibilidad limitada. Es decir, 50 de los 98 financiados están sometidos a algún tipo de restricción de uso, ya sea por indicación terapéutica, tipo de paciente, etc. Un porcentaje que ha crecido 10 puntos –41% en 2021– y que resulta muy superior al de países como Alemania (1%), Italia (12%) o Francia (17%).
Juan Yermo, director general de Farmaindustria, la Asociación Nacional Empresarial de la Industria Farmacéutica establecida en España, explica que “este problema de acceso a los medicamentos innovadores es un diagnóstico compartido entre las autoridades sanitarias, pacientes, profesionales e industria y requiere una solución urgente en la que ya estamos trabajando con la Administración, a la que hemos propuesto una serie de mejoras en el procedimiento de fijación de precios y financiación. El objetivo es establecer un modelo ágil, predecible y eficiente”.
El informe también revela una mejora en el acceso a los medicamentos huérfanos. Concretamente, en España estaban disponibles en 2022 el 51% de los nuevos fármacos aprobados para las enfermedades raras –frente a un 44% en 2021–. Sin embargo, este porcentaje sigue siendo muy inferior al de otros países de nuestro entorno como Alemania (90%), Italia (82%) o Francia (79%).
Para Juan Yermo, “el área de los medicamentos huérfanos es otra en la que debemos poner el foco, sobre todo teniendo en cuenta que el 40% de los fármacos autorizados en Europa ya son para enfermedades raras y que en muchos casos benefician a pacientes para los que no existe tratamiento alguno”.
Por el contrario, la situación ha empeorado en el caso de los nuevos medicamentos para el cáncer. Y es que su disponibilidad pasó de un 61% en 2021 al 57% el pasado año. Un porcentaje muy inferior al de otros países de la Unión: Alemania (98%), Italia (83%) o Francia (72%).
En cualquier caso, y si bien resulta más acusado en España, este problema de acceso es común a toda Europa, una de las razones por las que la Comisión Europea se propone llevar a cabo la mayor reforma en dos décadas de la legislación farmacéutica vigente en la UE.