Los más de 13.000 millones de dosis administradas han salvado millones de vidas
Nobel de Medicina para los descubridores de las vacunas de la COVID-19
El Premio Nobel de Medicina o Fisiología de 2023 ha recaído en Katalin Karikó (Szolnok, Hungría, 1955) y Drew Weissman (Lexington, EE.UU., 1959), investigadores responsables de los descubrimientos sobre modificaciones de bases de nucleósidos que han permitido el desarrollo de vacunas de ARNm eficaces contra la COVID-19.
Concretamente, el Instituto Karolinska de Estocolmo, institución responsable de la concesión del galardón, ha reconocido sus hallazgos innovadores que, absolutamente cruciales para el desarrollo de las vacunas frente a la COVID-19 durante la pandemia iniciada en 2020, han cambiado nuestra comprensión sobre cómo interactúa el ARNm con nuestro sistema inmune, posibilitando así un tasa sin precedentes de desarrollo de vacunas durante una de las mayores amenazas a la salud humana sucedida en tiempos recientes.
Estimular la respuesta inmune
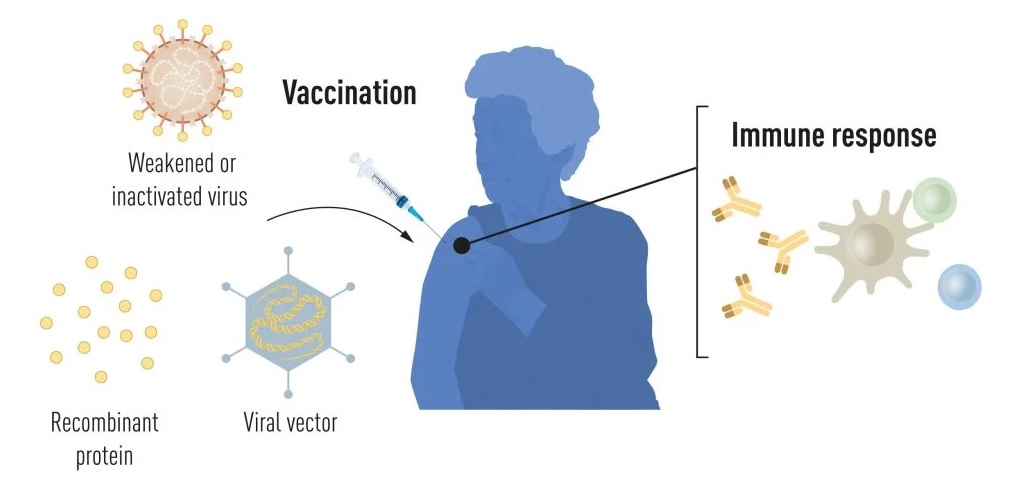
La vacunación estimula la formación de una respuesta inmune frente a un patógeno específico, dotando al organismo de una base para combatir la enfermedad en caso de una ulterior infección. Unas vacunas que, inicialmente basadas en virus debilitados, contienen en la actualidad, gracias a los progresos logrados en biología molecular, partes del código genético viral, por lo general para la producción de proteínas que, localizadas en la superficie viral, estimulan la producción de anticuerpos capaces de bloquear el virus y, por ende, negar su entrada en las células –como sucede, por ejemplo, en la vacuna frente al virus de la hepatitis B (VHB) o frente al virus del papiloma humano (VPH)
También hay una alternativa: insertar las partes del código genético viral en un segundo virus inerme denominado vector, tal y como ocurre en la vacuna del virus del Ébola. Y cuando este vector llegue a la célula se volverá a sintetizar la proteína codificada en el código genético insertado y se volverá a estimular una respuesta inmune.
Pero sigue habiendo un problema: da igual que la vacuna se base en un virus debilitado, en una parte de su secuencia genética o en un vector. Siempre harán falta cultivos celulares, y en cantidades inmensas, en los que fabricar estos estimulantes del sistema inmune, lo que limita en gran medida la producción en masa de vacunas en caso de una pandemia. Y aquí entran en juego las vacunas de ARNm.
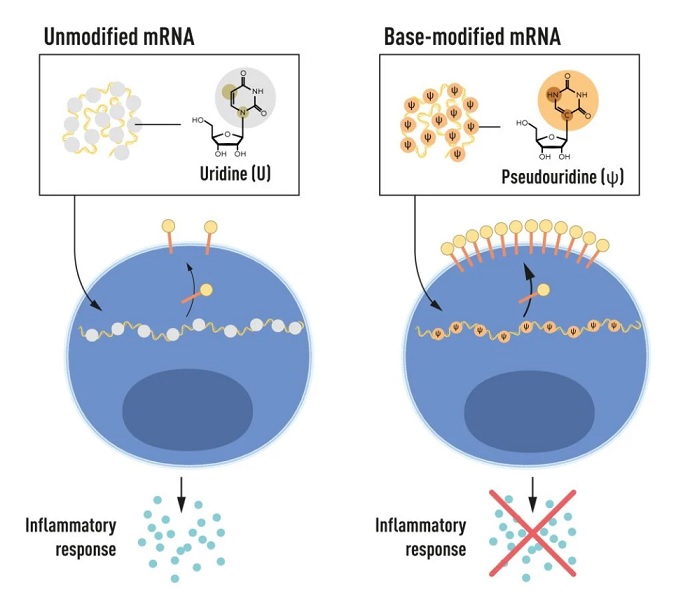
Pero, ¿qué es el ARN mensajero o ‘ARNm’? Básicamente es la molécula encargada de transmitir el código genético procedente del ADN a un ribosoma indicando el orden en el que se unirán los aminoácidos que darán lugar a la proteína. Y gracias a los avances logrados en la década de 1980, este ARNm se puede sintetizar mediante la transcripción ‘in vitro’, no siendo necesario recurrir a los cultivos celulares. Pero este método, que aceleraría, y mucho, la producción de vacunas, no está exento de problemas: el ARNm transcrito ‘in vitro’ es inestable y provoca reacciones inflamatorias.
Alteraciones químicas
Tras emigrar a Estados Unidos, la bióloga Katalin Karikó inició sus estudios en los años noventa para emplear el ARNm para el tratamiento de distintas enfermedades. Pero, salvo excepciones, sus planteamientos no fueron bien acogidos por la comunidad científica. Y una de estas excepciones fue su colega en la Universidad de Pensilvania, el inmunólogo Drew Weissman, interesado en las células dendríticas, que juegan un papel importante en la vigilancia inmune y en la activación de la respuesta inmune inducida por las vacunas.
En primer lugar, Karikó y Weissman vieron que las células dendríticas identificaban el ARNm transcrito ‘in vitro’ como una sustancia extraña, por lo que activaban una reacción inflamatoria, lo que no ocurría con el ARNm producido por las células. Y, una vez constataron en sus estudios que las bases de nucleósidos del ARNm de las células eran sometidas a numerosas modificaciones químicas, comenzaron a hacer lo mismo con las del ARNm transcrito ‘in vitro’. ¿El resultado? Se eliminó completamente toda respuesta inflamatoria, abriendo la posibilidad, ya en el año 2005, de emplear el ARNm como terapia.
Posteriormente, los trabajos de Karikó y Weissman mostraron que la alteración de las bases del ARNm también conllevaba un incremento muy significativo de la producción de proteínas y, llegado el año 2010, las compañías farmacéuticas se interesaron en la tecnología del ARNm, primero con el desarrollo de vacunas frente al virus del Zika y del coronavirus causante del síndrome respiratorio agudo grave (SARS), estrechamente emparentado con el coronavirus causante de la COVID-19 –el SARS-CoV-2.
Tras la irrupción de la pandemia de la COVID-19 en 2020, se produjeron en tiempo récord dos vacunas ARNm con bases de nucleósidos modificadas que codificaban una proteína de superficie del SARS-CoV-2. Unas vacunas que, con una eficacia protectora cercana al 95%, fueron ya aprobadas en diciembre de ese mismo año. El resto es historia: junto a otras vacunas basadas en distintas metodologías, a día de hoy ya se han inoculado más de 13.000 millones de dosis, salvando millones de vidas y evitando que muchos millones más hayan enfermado gravemente, permitiendo a la sociedad global volver a la normalidad.
Como destaca el Instituto Karolinska, “la impresionante flexibilidad y velocidad con las que las vacunas ARNm pueden ser desarrolladas abren el camino para el uso de esta nueva tecnología para vacunas frente a otras enfermedades infecciosas. En el futuro, además, esta tecnología también podría emplearse para el transporte de proteínas terapéuticas y el tratamiento de diversos tipos de cáncer”.