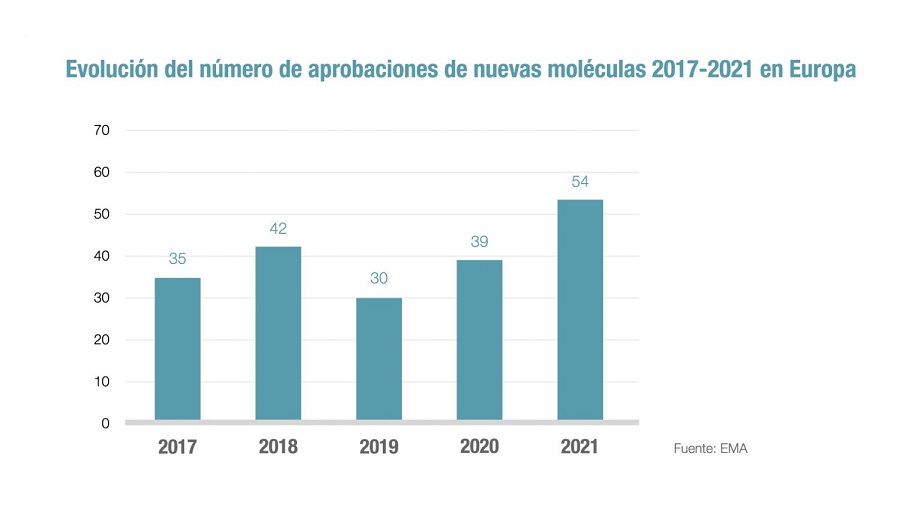
La Agencia Europea del Medicamento (EMA) autorizó en 2021 un total de 54 nuevos medicamentos, la cifra más alta de los últimos cinco años. En este último lustro el número de nuevos principios activos registrados se eleva a 200. Concretamente, las áreas terapéuticas con mayor número de aprobaciones en 2021 fueron: oncología, con 12; vacunas y tratamientos contra la COVID-19, con un total de siete; y hematología y neurología, con cinco cada una. Hasta un 35% de estas novedades terapéuticas, esto es 19 de 54, han sido consideradas medicamentos huérfanos, lo que revela el impulso de la investigación de la industria en al área de las enfermedades raras.
Entre las 54 novedades, que por primera vez en muchos años superan las registradas –50– en el mismo periodo por la Agencia Federal de Medicamentos y Alimentos de Estados Unidos (FDA), sobresalen dos nuevos medicamentos considerados terapias avanzadas. Y a todas ellas se suma la aprobación de 89 nuevas indicaciones para medicamentos ya autorizados, incluidas 35 para uso pediátrico.
De los nuevos principios activos aprobados, seis obtuvieron la designación ‘Prime’, el programa de la EMA para agilizar el acceso de los pacientes a medicamentos prometedores dirigidos a cubrir necesidades médicas no cubiertas mediante un procedimiento acelerado de evaluación. Un programa que, indica la propia Agencia, “desde su puesta en marcha en marzo de 2016, y hasta el primer semestre de 2021, ha permitido la aprobación de 18 medicamentos. Entre ellos, 10 recibieron una autorización de comercialización condicional, que les permite acceder al mercado antes y llegar a los pacientes con mayor rapidez, y siete son fármacos de terapia avanzada, que tienen el potencial de remodelar el tratamiento de una amplia gama de afecciones. La mayor parte de estos (16) están indicados para enfermedades raras”.